- Aprovada para uso em 6 países e pela Anvisa em janeiro de 2016
- 1ª Vacina contra Dengue, age como infecção natural
- Vacina de vírus vivos atenuados recombinante quimérico da vacina da Febre Amarela
Indicação: Prevenção de Dengue em áreas endêmicas, 9 a 45 anos, desde que já tiver sido infectado pelo vírus da Dengue ou Teste sorológico positivo para Dengue (Recomendação do Laboratório Sanofi Pasteur – 30/11/17)
- Eficácia:
- 66 % de eficácia para qualquer sorotipo
- 82% para os que já tiveram Dengue
- 53% para os que não tiveram Dengue
- 93% de proteção para Dengue Grave
- 81% redução de hospitalização
- Proteção para 4 sorotipos
- Esquema: 3 doses, com intervalo de 6 meses de 0,5 ml
- Reações adversas: Em 667 vacinados de 9 a 60 anos
- Muito comum (>10%): cefaléia, mialgia, dor no local, mal-estar (até 3 dias ), astenia, febre (até 14 dias)
- Comum: >1% e <10%: reações no local: eritema, hematoma, edema, prurido
- Incomum:>0,1% e <1%:IVAS, Linfoadenopatia, tontura, enxaqueca, dor orofaríngea, tosse, rinorreia, náusea, rash(exantema), urticária, dor no pescoço, artralgia, endurecimento local, gripe “like”
- Notificar qualquer evento adverso e para Alergo Vaccine (alergovaccine@gmail.com) e para SIV- Serviço de Informações de Vacinas da Sanofi: siv@sanofi.com ou 0800148480
- Contraindicada: Gestantes, Lactantes e Deficiência Imunológica Congênita ou Adquirida, uso de imunossupressores ( quimioterapia, radioterapia ou uso de Corticóides sistêmicos ) ou História de reação alérgica grave
Advertência e Precaução: A vacinação deve ser apenas recomendada quando o potencial benefício for maior que o potencial risco (para indivíduos vivendo em áreas com alta soroprevalência de dengue ou onde dados epidemiológicos indicam uma alta carga da doença). Os profissionais de saúde necessitariam avaliar a probabilidade de infecção prévia por dengue nesses indivíduos antes da vacinação. Para indivíduos que não tiveram infecção prévia pelo vírus da dengue, a vacinação não deve ser recomendada. A infecção prévia pelo vírus da dengue pode ser identificada através de teste sorológico, onde disponível.
- Anvisa recomenda que “ a vacina Dengvaxia® não seja administrada em indivíduos soronegativos, ou seja, sem exposição prévia ao vírus da dengue”.
- Adiar: Doença aguda ou febril moderada a grave
- Não engravidar por 4 semanas após vacinação
- Apresentação: Multidose ou Monodose
- Aplicação: SUBCUTÂNEA, preferencialmente deltóide
- A vacina não protege contra Zika e Chicungunya
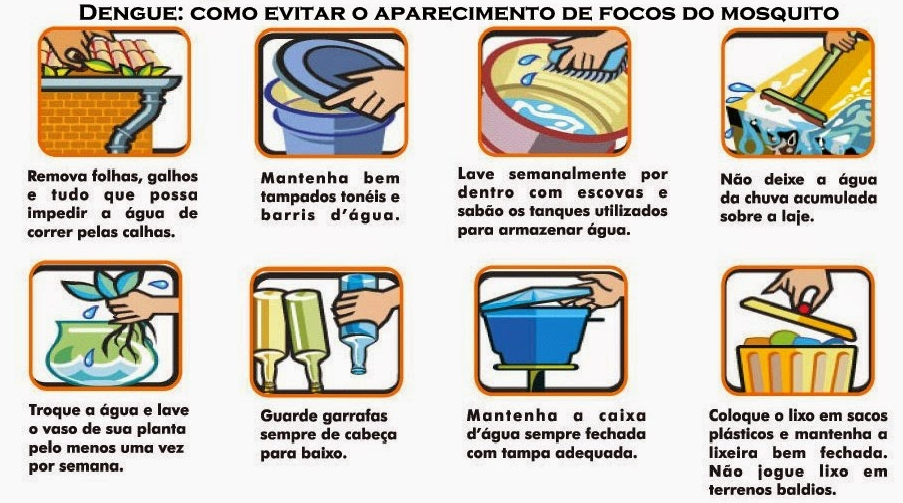
- Alem da vacinação, manter as medidas de prevenção do vetor e da picada do inseto com uso de repelentes, telas nas portas e nas janelas e mosquiteiros
 Autoria: Marta de Fátima R.C. Guidacci CRM: 7.600 DF
Autoria: Marta de Fátima R.C. Guidacci CRM: 7.600 DF- Bibliografia :
- Global strategy for dengue prevention and control 2012-2020
- WER 29 JULY 2016, 91th YEAR .No 30, 2016, 91, 349–364 http:/ www.who.int/wer
- Santos, AR et al. Os desafios no controle de dengue. Imunizações/V9/n.1/2016
- Ferguson NM et al. science, sept.2016 • vol 353 issue 6303
- Imagens disponíveis no Google
Posicionamento atualizado da Sanofi Pasteur frente ao esquema vacinal incompleto com Dengvaxia
A Sanofi Pasteur recomenda que o esquema vacinal seja concluído para indivíduos que já receberam 1 ou 2 doses da vacina contra dengue e não tem conhecimento de status de infecção prévia à dengue, levando em consideração as observações científicas abaixo:
1 – Os resultados globais dos estudos clínicos em indivíduos entre 9-16 anos, em países com altos índices endêmicos para dengue, continuaram a mostrar taxas mais baixas de (i) hospitalização e (ii) de formas graves da doença pelo vírus da dengue naqueles que foram vacinados em comparação com aqueles que não foram vacinados (com base em uma média de 80% de indivíduos soropositivos). Estima-se que maioria das pessoas que vive em áreas altamente endêmicas para dengue, como o Brasil, terá tido uma infecção pelo vírus da dengue quando chegar à adolescência. Além disso, cerca de 75% dos casos de dengue são assintomáticos, portanto existe a possibilidade de ter sido infectado e não ter manifestado sintomas.
2 – Os resultados foram obtidos com >90% dos participantes tendo completado o esquema de 3 doses de vacinação. Portanto, não existem dados se a proteção é similarmente sustentada quando os indivíduos não completam o esquema de 3 doses.
3 – Para os indivíduos soronegativos, em que os títulos de anticorpos neutralizantes são mais baixos do que nos soropositivos, uma única dose da vacina pode estimular a resposta imunológica; porém, esta pode ser seguida por diminuição precoce no título de anticorpos neutralizantes, caso nenhuma dose subsequente seja aplicada, permitindo que os indivíduos sejam suscetíveis a uma nova infecção mais cedo.
4 – Um esquema parcial (com apenas uma ou duas doses da vacina) pode não ser suficiente para manter uma proteção durante 25 meses em soronegativos.
5 – Nos indivíduos soronegativos, a forma clínica da doença após a vacinação não é pior/mais grave, em comparação com indivíduos soropositivos e que não foram vacinados. Ainda, é importante destacar que todos, vacinados (soropositivos ou soronegativos) ou não, mantenham as ações de controle e combate ao vetor e prevenção de picadas de mosquitos
Na expectativa de que essas informações venham ao encontro de suas necessidades, permanecemos à disposição em caso de solicitações adicionais.
Atenciosamente,
Serviço de Informação sobre Vacinação
.png)
IMUNIZAÇÃO
Vacina da dengue: qual é a recomendação?
Bula da vacina foi atualizada com nova recomendação para vacina da dengue da Sanofi Aventis para pessoas nunca infectadas pela dengue.
Por: Ascom/Anvisa – Publicado: 05/12/2017 18:31 – Última Modificação: 06/12/2017 00:24
Na última semana o fabricante da vacina da dengue, Dengvaxia, o laboratório Sanofi-Aventis, apresentou informações sobre um estudo complementar no qual foram comparadas pessoas vacinadas, já infectadas pela dengue, com pessoas não infectadas. Os grupos foram acompanhados durante seis anos desde a primeira dose.
Os dados preliminares mostraram que as pessoas não infectadas pela dengue antes de receber a vacina, podem ter mais chances de desenvolver formas mais graves da doença se fossem picadas pelo mosquito infectado com dengue.
A recomendação da Anvisa é: pessoas soronegativas (quem nunca teve contato com o vírus da dengue) não devem tomar a vacina.
O texto de bula atualizado da Dengvaxia já foi protocolado pela empresa e já está disponível no Bulário Eletrônico.
Acesse a bula do Dengvaxia agora.
Para esclarecer o caso, elaboramos algumas perguntas e respostas sobre o tema.
Qual a recomendação da Anvisa em relação à vacina da dengue?
A recomendação é: pessoas que nunca tiveram contato com o vírus não tomem a vacina.
Trata-se de uma precaução, pois os dados preliminares desse estudo complementar não são conclusivos. Em outras palavras, estatisticamente ainda não está confirmado se existe o aumento de risco na faixa etária para a qual a vacina é indicada (9 a 45 anos).
Para quem mora em áreas onde nunca foram registradas epidemias de dengue, a recomendação é não tomar a vacina, pois as pessoas dessas áreas provavelmente são soronegativas (nunca tiveram contato com o vírus da dengue).
Moradores de áreas onde já ocorreu epidemia de dengue devem avaliar, em conjunto com seu médico, a recomendação da vacina para definir os riscos da doença e os potenciais benefícios e riscos da vacinação.
Porque esses estudos só surgiram agora?
Todo medicamento novo continua sendo monitorado e pesquisado depois de receber o registro, ao chegar ao mercado. Esta fase se chama pós-mercado e serve exatamente para identificar situações não descritas durante a fase de pesquisa clínica, só identificáveis com o uso em larga escala e seu acompanhamento de longo prazo. Os dados dos estudos complementares de seis anos foram encaminhados pelo fabricante assim que ficaram prontos.
No caso da vacina da dengue, a fase de pesquisa, anterior ao registro, reuniu cerca de 40 mil pessoas de diferentes partes do mundo, inclusive no Brasil. Porém, mesmo com essa quantidade de pessoas alguns casos aparecem somente quando o medicamento começa a ser utilizado por um grupo maior de pessoas.
“Ter tido contato com o vírus” é o mesmo que ter ficado doente?
Não. A maioria das pessoas já infectadas pelos vírus da dengue não sabem disso. Ou seja, há pessoas infectadas pelo vírus, mas que não desenvolvem os sintomas da doença.
Qual o risco para quem tomou a vacina?
Em primeiro lugar, é importante esclarecer: a vacina não causa dengue. Quem causa dengue é o vírus, presente na maior parte do Brasil. Pessoas vacinadas ou não, ao serem picadas por mosquitos infectados, podem ou não apresentar sintomas da doença.
O estudo apontou que quem tomou a vacina e nunca teve contato anterior com o vírus pode apresentar um risco 0,5% maior de hospitalização e 0,2% para dengue grave, em comparação com as pessoas vacinadas previamente infectadas.
Tomei a primeira dose da vacina, devo tomar as outras doses?
Não há dados sobre o risco de doença grave e hospitalização de acordo com o número de doses recebidas.
As pessoas já vacinadas, com uma ou duas doses, devem procurar um profissional de saúde, para avaliar as características da doença na região onde o paciente vive, intensidade de transmissão e idade para avaliar o benefício de completar ou não o esquema de vacinação.
Mas se eu já tive dengue porque tomaria a vacina?
A dengue é uma doença causada por quatro sorotipos diferentes, é como se fossem quatro tipos de dengue. Então, mesmo se já teve dengue alguma vez, você pode adoecer novamente por outro sorotipo. Além disso, a vacina não tem 100% de eficácia contra o vírus, como já consta na bula.
Acho que nunca tive dengue, o que faço?
Se você mora em áreas onde nunca foram registradas epidemias de dengue, a recomendação é não tomar a vacina, pois as pessoas dessas áreas provavelmente são soronegativas (nunca tiveram contato com o vírus da dengue).
Se mora em áreas onde já ocorreu epidemia de dengue é importante avaliar, em conjunto com seu médico, a recomendação da vacina para discutir os riscos da doença e potenciais benefícios e riscos da vacinação.
Já me vacinei, e agora?
A orientação é a mesma para pessoas vacinadas ou não, ou seja, todos devem manter devem manter as medidas preventivas contra a picada do mosquito após a vacinação e devem procurar um médico caso desenvolvam sinais da dengue. Estes sinais são febre alta persistente por mais de dois dias, dor ou sensibilidade abdominal grave, persistência de vômito, sangramento da mucosa, sonolência e hiperatividade, conforme diretrizes da OMS, 2009.
De que tipo de gravidade estamos falando?
Na escala de 1 a 4 (sendo 4 o mais alto, conforme classificação da OMS de 1997), utilizada no estudo a maioria dos casos ficaram em 1 e 2, ou seja, menos graves. Não foram registadas mortes durante os estudos clínicos relacionadas à vacinação e todos os casos se recuperaram com tratamento de rotina.
Porque pessoas já vacinadas podem ter dengue?
Nenhuma vacina garante 100% de proteção. No caso da vacina da dengue a média é 66% de proteção, a redução de hospitalizações de 80% e a proteção contra formas graves de 93% após a terceira dose da vacina.
Fonte:http://portal.anvisa.gov.br/web/guest/noticias/-/asset_publisher/FXrpx9qY7FbU/content/vacina-da-dengue-qual-e-a-recomendacao-/219201
What is the current status of dengue vaccine development?
There is a growing public health need for effective preventive interventions against dengue, a disease caused by four viruses, termed serotypes 1-4. A safe, effective and affordable dengue vaccine against the four strains would represent a major advance for the control of the disease and could be an important tool for reaching the WHO goal of reducing dengue morbidity by at least 25% and mortality by at least 50% by 2020. One dengue vaccine has been licensed, Dengvaxia® (CYD-TDV), developed by Sanofi Pasteur. Approximately five additional dengue vaccine candidates are in clinical development, with two candidates (developed by Butantan and Takeda) expected to begin Phase III trials in early 2016.
What is Dengvaxia® (CYD-TDV)?
CYD-TDV is the first dengue vaccine to be licensed. It was first licensed in Mexico in December 2015 for use in individuals 9-45 years of age living in endemic areas. CYD-TDV is a live recombinant tetravalent dengue vaccine developed by Sanofi Pasteur (CYD-TDV), given as a 3-dose series on a 0/6/12 month schedule.
What are the results from the Phase 3 trials?
CYD-TDV has been evaluated in two Phase 3 clinical trials (CYD14 in five countries in Asia and CYD15 in five countries in Latin America). Together, these trials included over 35,000 participants aged 2 to 16 years: ages at first vaccination were 2 to 14 years in CYD14, 9 to 16 years in CYD15. In each of these trials, participants were randomized to vaccine and placebo in a 2:1 ratio. The study protocols included an active phase of follow-up for one year after the last dose of vaccine in the series (25 months from dose 1) and include a hospital-based follow-up period of four additional years, which is ongoing.
Results have been published for each trial separately, as well as pooled. Trial results include children aged <9 years old, which is an age group that is not included in the current indication. This is due to results that were observed during the Phase 3 trials in the youngest age group in the CYD14 Phase 3 trial.
Vaccine efficacy against confirmed dengue pooled across both trials was 59.2% in the year following the primary series (per protocol analysis). During this initial time period, pooled vaccine efficacy against severe dengue was 79.1%. Efficacy varied by serotype: vaccine efficacy was higher against serotypes 3 and 4 (71.6% and 76.9%, respectively) than for serotypes 1 and 2 (54.7% and 43.0%). Vaccine efficacy also varied by age at vaccination and serostatus at baseline (i.e., previous exposure to dengue prior to vaccination).
When limited to older age groups (ages included in the current licensure), pooled vaccine efficacy amongst all participants aged 9 years or over was 65.6%, and in participants aged <9 years it was 44%.
Within the randomized subset of participants for whom pre-vaccination blood samples were collected, pooled vaccine efficacy against VCD in those seropositive for a prior exposure to dengue virus was 78.2%, while in those seronegative at baseline it was 38.1% (not statistically significant). In a post-hoc analysis in those ≥9 years of age, vaccine efficacy in those seronegative at baseline was 52.5% (95% CI 5.9%, 76.1%).
While efficacy was reported against hospitalized and severe dengue in Years 1 and 2 post-dose 1, an excess of cases of hospitalized and severe dengue cases in those receiving CYD-TDV was seen in Year 3 in some subgroups, although it is based on relatively small numbers of cases. The excess was mostly observed in those vaccinated aged 2-5 years in CYD14 in Asia, for which the relative risk of hospitalized dengue in vaccinees was 7.45 (95% CI 1.15, 313.80) in Year 3, based on 15 cases in the CYD-TDV group and 1 case in the control group. This younger age group has not been included in the age indication of the vaccine. No safety signals were reported in the older age groups.
What are WHO’s recommendations related to CYD-TDV?
WHO recommends that countries should consider introduction of the dengue vaccine CYD-TDV only in geographic settings (national or subnational) where epidemiological data indicate a high burden of disease. Complete recommendations may be found in the WHO position paper on dengue vaccines.
Has the vaccine been prequalified by WHO?
CYD-TDV is currently not prequalified. Prequalification requires an NRA of record, which is typically the NRA in the manufacturing country (in this case, EMA). WHO is awaiting a submission of an application from the manufacturer for prequalification of this vaccine.
What other interventions exist for dengue control?
Vector control has been the key strategy to control or prevent the transmission of dengue virus. Strategies include:
- preventing mosquitoes from accessing egg-laying habitats by environmental management and modification;
- disposing of solid waste properly and removing artificial man-made habitats;
- covering, emptying and cleaning of domestic water storage containers on a weekly basis;
- applying appropriate insecticides to water storage outdoor containers;
- using of personal household protection such as window screens, long-sleeved clothes, insecticide treated materials, coils and vaporizers;
- improving community participation and mobilization for sustained vector control;
- applying insecticides as space spraying during outbreaks as one of the emergency vector-control measures
- active monitoring and surveillance of vectors should be carried out to determine effectiveness of control interventions.
Questions and answers on previous clinical trial results of CYD-TDV
Results from the pooled Phase 3 trials for efficacy and longer-term safety of CYD-TDV have been published in July 2015.
- More information on the pooled efficacy and longer-term safety of CYD-TDV (July 2015)
pdf, 124kb - More information on the pooled efficacy and longer-term safety of CYD-TDV (July 2015) – Spanish version
pdf, 166kb
Results from a phase III multicentric efficacy study in Latin America have been published in November 2014.
- More information on the phase III study of CYD-TDV in Latin America (November 2014)
pdf, 63kb - More information on the phase III study of CYD-TDV in Latin America (November 2014) – Spanish version
pdf, 98kb
Results from a phase III multicentric efficacy study in Asia have been published in July 2014.
- More information on the phase III study of CYD-TDV (July 2014)
pdf, 142kb - More information on the phase III study of CYD-TDV (July 2014) Spanish version
pdf, 98kb
Results from a phase IIb efficacy study in Thailand have been published in September 2012.
Nota Informativa
Vacina Dengue Dengvaxia®
- A Dengvaxia® – vacina dengue 1, 2, 3 e 4 (recombinante, atenuada), primeira vacina contra dengue registrada no Brasil, teve seu registro concedido pela Anvisa em 28/12/2015.
- A vacina foi registrada com a indicação de prevenção da dengue causada pelos sorotipos 1, 2, 3 e 4 do vírus da dengue em indivíduos dos 9 aos 45 anos de idade que moram em áreas endêmicas. O esquema de vacinação primária consiste de 3 doses a serem administradas em intervalos de 6 meses.
- O registro da vacina foi baseado em ensaios clínicos realizados em vários países, sendo que estudos de Fases 2 e 3 foram conduzidos também no Brasil. Anteriormente ao registro, a vacina foi estudada em mais de 40.000 indivíduos em todo o mundo. Os ensaios clínicos seguiram os preceitos estabelecidos por guias internacionais como “Guidelines for the clinical evaluation of dengue vaccines in endemic areas” da Organização Mundial da Saúde (OMS).
- Os dados inicialmente apresentados para o registro da vacina indicaram benefício para a população geral, sendo este maior em indivíduos com exposição prévia ao vírus da dengue (soropositivos). Para os indivíduos soronegativos, no momento do registro, foi demonstrado um benefício menor, mas sem risco aumentado de reações adversas graves. Informações adicionais relacionadas à Dengvaxia® podem ser obtidas na carta de aprovação (http://www.anvisa.gov.br/datavisa/Fila_de_analise/index.asp) e nas perguntas e respostas disponibilizadas pela Anvisa no momento do registro da vacina (http://portal.anvisa.gov.br/noticias/-/asset_publisher/FXrpx9qY7FbU/content/tire-suas-duvidas-sobre-a-vacina-da-dengue/219201?inheritRedirect=false).
- Após a concessão do registro sanitário, para fins de monitoramento da vacina e seguimento dos indivíduos incluídos nos estudos clínicos, a empresa conduziu ensaios adicionais para avaliação da relação benefício-risco em cada subpopulação de indivíduos (soropositivos e soronegativos). De acordo com os resultados obtidos e apresentados pela empresa à Anvisa em reunião no dia 27/11/2017, tais dados de seguimento demonstram que, após cinco anos da administração da vacina, permanece positivo o benefício da vacinação na população geral e em indivíduos previamente soropositivos. No entanto, para indivíduos previamente soronegativos, depois de 30 meses após a 1ª dose da vacina, ocorre um aumento do risco de exacerbação da doença, com aumento de casos de dengue severa e hospitalização, ficando este risco acima daquele para indivíduos soronegativos que não receberam a vacina, embora os dados ainda não sejam conclusivos. Conforme esses dados preliminares, tal risco é traduzido em cinco casos de hospitalização para cada 1.000 indivíduos soronegativos vacinados e em dois casos de dengue severa para cada 1.000 indivíduos soronegativos vacinados. Esses dados precisarão ser confirmados pela continuidade dos estudos em andamento.
- Dessa forma, além da divulgação deste comunicado, a Anvisa determina que a bula do produto será alterada para informar sobre o risco aumentado de hospitalização e dengue severa em indivíduos soronegativos. A bula alterada estará disponível no bulário eletrônico da Anvisa (http://www.anvisa.gov.br/datavisa/fila_bula/index.asp).
- Esclarecemos que o benefício da vacina permanece positivo para indivíduos anteriormente expostos ao vírus da dengue, mesmo após 5 anos do recebimento da vacina, em termos de hospitalização e ocorrência de dengue severa.
- A Anvisa já solicitou os documentos completos referentes aos estudos de monitoramento realizados pela empresa Sanofi-Aventis e informa que outras ações poderão ser adotadas na medida em que os dados forem avaliados. A Agência também permanece comprometida em divulgar todas as atualizações necessárias sobre o tema, a fim de manter a população informada sobre a avaliação da relação benefício-risco da vacina Dengvaxia®.
- Neste momento, e até que os dados sejam avaliados, a Anvisa recomenda que a vacina Dengvaxia® não seja administrada em indivíduos soronegativos, ou seja, sem exposição prévia ao vírus da dengue.
- Por fim, informamos que em 28/11/2017 a Anvisa participou de teleconferência com especialistas do grupo de vacinas da Organização Mundial da Saúde e continuará acompanhando ativamente essas discussões.
- A Anvisa é uma autoridade de referência mundial em vacinas, pré-qualificada tanto pela OPAS quanto pela OMS, que está comprometida com o interesse público, alinhada à necessidade e à importância da disponibilização de vacinas seguras, eficazes e de qualidade para a população brasileira e reforça que a prevenção de doenças por meio da vacinação é uma medida de extrema importância para a saúde pública e deve permanecer como prioritária para o controle sanitário de doenças infecciosas.
SANOFI ATUALIZA INFORMAÇÕES SOBRE A VACINA CONTRA A DENGUE
Sanofi atualiza informações sobre a vacina contra a dengue Resultados adicionais de um estudo de acompanhamento de longo prazo da eficácia e da segurança de Dengvaxia® demonstram diferenças no desempenho da vacina entre indivíduos com e sem infecção prévia por dengue A companhia já apresentou para a ANVISA a proposta de atualização de bula com a nova informação São Paulo, BRASIL – 29 de Novembro de 2017 – A Sanofi Pasteur solicitou à Agência Nacional de Vigilância Sanitária, ANVISA, atualização das informações para médicos e pacientes sobre a vacina contra dengue Dengvaxia® nos países onde está aprovada, como o Brasil. A demanda é baseada numa nova análise de acompanhamento de longo prazo de dados de estudo clínico, que demonstrou diferenças no desempenho da vacina de acordo com infecção prévia por dengue. Como resultado, a ANVISA disse que irá avaliar os dados apresentados pela companhia. Enquanto isso, a agência publicou em seu site que “recomenda que a vacina Dengvaxia® não seja administrada em indivíduos soronegativos, ou seja, sem exposição prévia ao vírus da dengue”. A Sanofi Pasteur realizou esta análise complementar, em dados de ensaios clínicos de longo prazo, coletados durante seis anos, para avaliar ainda mais o desempenho comparativo da vacina em pessoas que foram infectadas com o vírus da dengue antes da vacinação e aquelas que não foram. Para pessoas que tiveram infecção prévia do vírus, os resultados desta nova análise confirmam o valor de proteção significativo e de longo prazo de Dengvaxia.
Para aqueles que não foram previamente infectados pelo vírus da dengue, entretanto, a análise mostrou que, em longo prazo, mais casos da forma grave da doença podem ocorrer, após uma subsequente infecção por dengue. “As pessoas podem ser infectadas pela dengue até quatro vezes durante a vida”, explica Sheila Homsani, diretora médica da Sanofi Pasteur Brasil. “Algumas infecções resultam em doença sintomática, mas a maioria dos casos são silenciosos e assintomáticos, o que significa que a prevalência da dengue é sub-reportada. A forma severa da doença após a infecção por dengue é rara, mas pode ocorrer depois de qualquer picada de um mosquito que carregue o vírus. Entretanto, a dengue é uma doença complexa e as pessoas têm maior probabilidade de contrair a forma grave após uma infecção secundária de um subtipo diferente do vírus.” Aproximadamente metade da população mundial vive em países onde os quatro sorotipos da dengue estão em circulação. Todo ano, cerca de 390 milhões de infecções por dengue são reportadas. As pessoas podem ser infectadas pela dengue até quatro vezes na vida e podem desenvolver a forma grave da doença depois de qualquer uma dessas infecções. Dados de vigilância de alguns países endêmicos indicam que entre 70% e 90% das pessoas serão expostas ao vírus da dengue pelo menos uma vez até chegarem à adolescência. Há muitos fatores que levam à infecção severa por dengue. Entretanto, o maior risco de desenvolver a forma severa foi observado em pessoas infectadas uma segunda vez por um diferente tipo de vírus. Dengvaxia é atualmente indicada na maioria dos países para indivíduos de nove anos ou mais que vivem em áreas endêmicas para dengue. Nessa população indicada, Dengvaxia tem demonstrado prevenção de 93% de casos severos e redução 80% de hospitalizações causadas pela doença durante os 25 meses de estudos clínicos de larga escala conduzidos em 10 países da América Latina e Ásia, onde a dengue é muito difundida. Proposta de atualização da bula Baseada nas novas análises, a Sanofi vai propor que as agências regulatórias nacionais atualizem as informações de prescrição, conhecidas em muitos países como bula, solicitando que os profissionais de saúde acessem a probabilidade de infecção prévia por dengue do indivíduo antes da vacinação. A vacinação deve apenas ser recomendada quando os potenciais benefícios ultrapassarem os potenciais riscos (em países com alta carga da doença).
Para indivíduos que não foram previamente infectados pelo vírus da dengue, a vacinação não deve ser recomendada. A proposta de bula da Sanofi será revisada pelas agências regulatórias nacionais em cada um dos países onde a vacina é registrada ou está sendo considerada para registro. Após sua revisão, cada agência pode alterar a proposta de bula apresentada pela companhia. Sobre Dengue A dengue é uma doença viral dolorosa e debilitante transmitida por um mosquito e para a qual não há tratamento. Quase 4 bilhões de pessoas vivem em risco de contrair dengue e não apenas uma vez, mas quatro vezes na vida. Durante as estações chuvosas, a dengue atinge fortes surtos que se espalham rapidamente nos centros de crescimento urbano dos países endêmicos. A Organização Mundial da Saúde pediu aos países com dengue que adotem uma abordagem integrada para a prevenção e gestão da doença, com o objetivo de reduzir as mortes por dengue em 50% e doenças e deficiências relacionadas em 25% até 2020. Sobre a Sanofi A Sanofi se dedica a apoiar as pessoas ao longo de seus desafios de saúde. Somos uma companhia biofarmacêutica global com foco em saúde humana. Prevenimos doenças por meio de nossas vacinas e proporcionamos tratamentos inovadores para combater dor e aliviar sofrimento. Nós estamos ao lado dos poucos que convivem com doenças raras e dos milhões que lidam com doenças crônicas. Com mais de 100 mil pessoas em 100 países, a Sanofi está transformando inovação científica em soluções de cuidados com a saúde em todo o mundo. Sanofi, Empowering Life, uma aliada na jornada de saúde das pessoas. Este material é dirigido exclusivamente à imprensa especializada como fonte de informação. As informações veiculadas neste documento têm caráter apenas informativo e não podem substituir, em qualquer hipótese, as recomendações do médico ou farmacêutico, nem servir de subsídio para efetuar um diagnóstico médico ou estimular a automedicação. O médico é o único profissional competente para prescrever o melhor tratamento para o seu paciente. Informações para Imprensa – Ketchum Aline Veríssimo – (11) 5090-8900 R 8437 | aline.verissimo@ketchum.com.br Nathália de Angelis – (11) 5090-8900 R 8644 | nathalia.angelis@ketchum.com.br Ana Luiza Petry – (11) 5090- 8900 R 8828 | analuiza.petry@ketchum.com.br Danilo Ribeiro – (11) 5090-8900 R 8510 | danilo.ribeiro@ketchum.com.br
http://www.sanofi.com.br/l/br/pt/layout.jsp?cnt=47D6436E-D8BF-43DF-A141-AE04F4DE6392
Bula
DENGVAXIA®
vacina dengue 1, 2, 3 e 4 (recombinante e atenuada)
APRESENTAÇÕES
Pó liofilizado e diluente para suspensão injetável em embalagens com:
– 1 frasco-ampola com uma dose + 1 seringa com 0,5mL de diluente
– 10 frascos-ampola com uma dose + 10 seringas com 0,5mL de diluente
– 5 frascos-ampola com cinco doses + 5 frascos-ampola com 2,5mL de diluente
VIA SUBCUTÂNEA.
USO PEDIÁTRICO E ADULTO DOS 9 AOS 45 ANOS DE IDADE.
COMPOSIÇÃO
Após a reconstituição, uma dose (0,5 mL) contém:
Vírus quimérico febre amarela – dengue
sorotipo 1 *
……. 4,5 – 6,0 log10 DICC50/dose**
Vírus quimérico febre amarela – dengue
sorotipo 2 *
……. 4,5 – 6,0 log10 DICC50/dose**
Vírus quimérico febre amarela – dengue
sorotipo 3 *
……. 4,5 – 6,0 log10 DICC50/dose**
Vírus quimérico febre amarela – dengue
sorotipo 4 *
……. 4,5 – 6,0 log10 DICC50/dose**
* Produzido em células Vero sem soro. Cada um dos quatro sorotipos do vírus da dengue
contidos na vacina foi obtido separadamente por tecnologia de DNA recombinante,
combinando o vírus atenuado da vacina febre amarela (17D204) e os quatro sorotipos dos
vírus selvagens da dengue.
** DICC50: Dose Infectante para 50% das Culturas Celulares.
Excipientes:
Não são adicionados adjuvantes ou conservantes.
Liofilizado: aminoácidos essenciais, incluindo fenilalanina, aminoácidos não essenciais,
cloridrato de arginina, sacarose, trealose di-hidratada, sorbitol, trometamol e ureia.
Para a apresentação monodose, a quantidade estimada de fenilalanina é aproximadamente de
0,041 mg por dose de 0,5 mL da vacina reconstituída.
Para a apresentação multidose, a quantidade estimada de fenilalanina é aproximadamente de
0,0077 mg por dose de 0,5 mL da vacina reconstituída.
Diluente para reconstituição: cloreto de sódio e água para injetáveis.
INFORMAÇÕES AO PACIENTE:
- PARA QUE ESTE MEDICAMENTO É INDICADO?
A Dengvaxia® é uma vacina utilizada para ajudar a proteger você ou seu filho contra a dengue
causada pelos sorotipos 1, 2, 3 e 4 do vírus da dengue. A Dengvaxia® é aplicada em adultos,
adolescentes e crianças dos 9 aos 45 anos de idade que moram em áreas endêmicas.
- COMO ESTE MEDICAMENTO FUNCIONA?
A Dengvaxia® contém os sorotipos 1, 2, 3 e 4 do vírus da dengue que foram enfraquecidos. A
Dengvaxia® age estimulando as defesas naturais do corpo (sistema imunológico), que produz
sua própria proteção (anticorpos) contra os vírus que causam a dengue.
- QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Este medicamento é contraindicado para uso por pessoas que:
são alérgicas (hipersensíveis) aos princípios ativos ou qualquer outro ingrediente de
Dengvaxia®.
desenvolveram uma reação alérgica após a administração prévia de Dengvaxia®. Os
sinais de uma reação alérgica podem incluir urticária, encurtamento da respiração, e
inchaço do rosto e da língua.
têm um sistema imunológico enfraquecido, por exemplo, devido a um problema
genético, infecção por HIV ou terapias que afetam o sistema imunológico (por
exemplo, altas doses de corticosteroides, quimioterapia ou radioterapia). As condições
que podem afetar o sistema imune incluem leucemia, linfoma ou outra doença
neoplásica maligna que afete a medula óssea ou sistema linfático.
estão grávidas.
estão amamentando.
Não utilize Dengvaxia® se você ou sua criança estão com febre de moderada a alta ou doença
aguda. Neste case, seu médico irá adiar a administração de Dengvaxia® até que você ou sua
criança tenha se recuperado.
- O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Advertências e precauções
Antes de receber Dengvaxia®, informe ao seu médico ou enfermeiro se você ou sua criança:
está recebendo um tratamento imunossupressor (20mg ou 2mg/kg de peso corpóreo de
prednisona ou equivalente por 2 semanas ou mais). Seu médico irá adiar a administração de
Dengvaxia® até 4 semanas após você ter interrompido o tratamento.
apresentou qualquer problema de saúde após a administração prévia de quaisquer vacinas.
Seu médico irá considerar cuidadosamente os riscos e benefícios da vacinação.
está recebendo tratamento com imunoglobulinas ou produtos hemoderivados contendo
imunoglobulinas, tais como sangue ou plasma. É recomendado esperar por, pelo menos, 6
semanas, e, preferencialmente, por 3 meses, após o fim do tratamento antes de administrar
Dengvaxia®, para evitar neutralização do vírus atenuado contido na vacina.
Assim como todas as vacinas, a Dengvaxia® pode não proteger 100% das pessoas vacinadas. A
vacinação com Dengvaxia® _________não é um substituto para a proteção contra as picadas de mosquitos.
Você deve tomar as precauções apropriadas para você e sua criança prevenirem as picadas de
mosquito, incluindo o uso de repelentes, roupas adequadas e redes de proteção contra
mosquitos.
O desmaio, frequentemente acompanhado de queda, pode ocorrer (principalmente em
adolescentes) após, ou até mesmo antes, de qualquer injeção com uma agulha. Portanto, informe ao médico, farmacêutico ou enfermeiro se você ou sua criança já desmaiaram com uma injeção prévia.
Indivíduos que não foram previamente infectados pelo vírus da dengue ou aqueles cuja
informação seja desconhecida
Em indivíduos que não foram previamente infectados pela dengue, um risco aumentado de
hospitalização pela dengue e dengue clinicamente grave (predominantemente Grau 1 e 2 da
Febre Hemorrágica da Dengue – OMS, 1997) tem sido observado no acompanhamento em
longo prazo dos estudos clínicos. (Veja a seção de Reações Adversas).
A vacinação deve ser apenas recomendada quando o potencial benefício for maior que o
potencial risco (para indivíduos vivendo em áreas com alta soroprevalência de dengue ou onde
dados epidemiológicos indicam uma alta carga da doença). Os profissionais de saúde
necessitariam avaliar a probabilidade de infecção prévia por dengue nesses indivíduos antes da
vacinação. Para indivíduos que não tiveram infecção prévia pelo vírus da dengue, a vacinação
não deve ser recomendada. A infecção prévia pelo vírus da dengue pode ser identificada através de teste sorológico, onde disponível.
Viajantes
A vacinação não é recomendada para indivíduos sem infecção prévia por dengue vivendo em
áreas não endêmicas, mesmo viajando para áreas endêmicas.
Crianças
As crianças menores de 9 anos de idade não devem receber esta vacina.
Utilizando outros medicamentos e Dengvaxia®
A Dengvaxia® pode não ter um efeito ideal se for utilizada junto com medicamentos que
suprimem o sistema imunológico, tais como corticosteroides, radioterapia ou quimioterapia.
Converse com o seu médico caso esteja utilizando algum desses medicamentos.
A Dengvaxia® não deve ser misturada com qualquer outra vacina ou produto farmacêutico
injetável.
Caso alguma outra vacina ou produto farmacêutico seja administrada(o) concomitantemente,
devem ser usadas seringas e agulhas diferentes, locais de administração diferentes e,
preferencialmente, membros diferentes.
Nenhum estudo específico foi realizado sobre a administração concomitante de Dengvaxia®
com qualquer outra vacina ou outro produto farmacêutico em indivíduos dos 9 aos 45 anos de
idade que moram em áreas endêmicas.
Informe ao seu médico se você ou sua criança está fazendo uso ou usou recentemente qualquer
outra vacina ou qualquer outro medicamento, incluindo medicamentos obtidos sem prescrição
médica.
Informe ao seu médico se você está fazendo uso de algum outro medicamento.
Gravidez e amamentação
A Dengvaxia® não deve ser administrada em mulheres grávidas ou que estão amamentando.
Se você:
está em idade fértil, você deve tomar as precauções necessárias para evitar a gravidez
por um mês após a administração de Dengvaxia®.
está grávida ou amamentando, se acredita que você possa estar grávida ou se está
planejando engravidar, consulte o seu médico antes de utilizar Dengvaxia®.
Esta vacina não deve ser utilizada em mulheres grávidas.
Efeitos sobre a capacidade de dirigir e operar máquinas
Não há dados disponíveis sobre os efeitos de Dengvaxia® na capacidade de dirigir ou operar
máquinas.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua
saúde.
Atenção fenilcetonúricos: contém fenilalanina.
- ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE
MEDICAMENTO?
O prazo de validade da vacina é 36 meses.
Não utilize a Dengvaxia® após a data de validade indicada no cartucho. A data de validade é
referente ao último dia do mês indicado.
Armazenar em refrigerador (entre +2C e +8C).
Não congelar.
Manter a vacina dentro do cartucho para protegê-la da luz.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem
original.
A vacina é um pó liofilizado branco e homogêneo com possível retração na base e pode formar
um bolo anelado.
O diluente é um líquido límpido e incolor.
Após a reconstituição com o diluente fornecido, a Dengvaxia® é um líquido límpido e incolor
com a possível presença de partículas brancas a translúcidas.
Apresentação monodose:
Após preparo, a Dengvaxia® deve ser utilizada imediatamente.
Apresentação multidose:
Após a reconstituição com o diluente fornecido, a Dengvaxia® deve ser usada assim que
possível e descartada no fim da sessão de vacinação ou em até 6 horas, o que ocorrer
primeiro. Durante este período, a Dengvaxia® deve ser mantida entre +2°C e +8°C, ou
seja, em refrigerador, e protegida da luz.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e
você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá
utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
- COMO DEVO USAR ESTE MEDICAMENTO?
A Dengvaxia® é administrada por seu médico ou enfermeiro, após ser totalmente dissolvida no
diluente fornecido, através de uma injeção sob a pele (via subcutânea) no braço.
Você ou sua criança receberá 3 injeções de 0,5 mL cada em intervalos de 6 meses. A primeira
injeção ocorrerá na data escolhida ou agendada, a segunda injeção ocorrerá 6 meses após a
primeira injeção, e a terceira injeção ocorrerá 6 meses após a segunda injeção. A Dengvaxia®
deve ser utilizada conforme o cronograma de vacinação local.
A necessidade de uma dose de reforço após a vacinação primária com Dengvaxia® não foi
estabelecida.
As instruções de reconstituição são direcionadas aos profissionais de saúde e são apresentadas
na bula do profissional de saúde.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do
tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
- O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE
MEDICAMENTO?
Se você ou sua criança perder uma injeção programada, seu médico decidirá quando deverá
administrar a injeção perdida.
É importante que você ou sua criança siga as instruções de seu médico em relação às visitas de
retorno para as aplicações seguintes. Se você esqueceu ou não pode retornar ao seu médico no
momento programado, consulte o seu médico.
Em caso de dúvidas, procure orientação de seu médico.
- QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Como todo medicamento, a Dengvaxia® pode causar efeitos adversos, embora isso não ocorra
com todas as pessoas.
Dados em indivíduos de 9 anos ou mais
Reações alérgicas graves
Se quaisquer desses sintomas ocorrerem após você deixar o local onde você ou sua criança
receberam a injeção, você deve consultar um médico IMEDIATAMENTE:
dificuldade em respirar,
cor azulada da língua ou lábios,
erupção cutânea,
inchaço da face ou garganta.
pressão sanguínea baixa causando tontura ou queda.
mal-estar grave e repentino com queda da pressão sanguínea causando tontura e perda
de consciência, taxa cardíaca acelerada associada a distúrbios respiratórios.
Quando estes sinais ou sintomas (sinais ou sintomas de reações anafiláticas) ocorrem, eles
geralmente se desenvolvem rapidamente após a administração da injeção e enquanto você ou
sua criança ainda estão na clínica ou consultório médico. Estes também podem ocorrer muito
raramente após o recebimento de qualquer vacina (pode afetar até 1 em 10.000 pessoas).
Outros efeitos adversos
Os seguintes efeitos adversos foram relatados durante estudos clínicos em crianças, adolescentes
e adultos (dos 9 aos 60 anos de idade). A maioria dos efeitos adversos relatados ocorreram
dentro de 3 dias após a administração de Dengvaxia®.
Reações muito comuns (ocorre em mais de 10% dos pacientes que utilizam este
medicamento):
dor de cabeça
dor muscular (mialgia)
mal-estar geral
fraqueza (astenia)
dor no local da injeção
febre
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
reações no local da injeção: vermelhidão (eritema), hematoma, inchaço e coceira
(prurido).
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este
medicamento):
infecções do trato respiratório superior
tontura
dor de garganta (dor orofaríngea)
tosse
coriza (rinorreia)
náusea
erupção de pele (rash)
dor no pescoço
endurecimento da pele no local da injeção
Efeitos adversos adicionais em adultos (dos 18 aos 60 anos de idade):
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este
medicamento):
gânglios inchados (linfadenopatia)
enxaqueca
dor nas juntas (artralgia)
sintomas semelhantes aos da gripe
Efeitos adversos adicionais em crianças e adolescentes (dos 9 aos 17 anos de idade):
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este
medicamento):
Urticária
Dengue clinicamente grave e/ou com hospitalização nos dados de acompanhamento de
segurança em longo prazo
Em uma análise exploratória de até 6 anos de acompanhamento desde a primeira injeção em três
estudos de eficácia, um risco aumentado de hospitalização por dengue, incluindo dengue
clinicamente grave (predominantemente Grau 1 e 2 da Febre Hemorrágica da Dengue – OMS,
1997) tem sido observado nos vacinados sem infecção prévia por dengue. Em indivíduos de 9
anos de idade ou mais, foi estimado que durante um acompanhamento de 5 anos, cerca de 5
casos adicionais de dengue com hospitalização ou 2 casos adicionais de dengue grave, a cada
1000 vacinados sem infecção prévia por dengue, poderiam ocorrer após a vacinação. As
estimativas a partir da análise em longo prazo sugerem que o início do risco aumentado foi
principalmente durante o terceiro ano após a primeira injeção.
Este risco aumentado não foi observado em indivíduos que foram previamente infectados pelo
vírus da dengue, onde estimou-se que 15 casos de dengue com hospitalização ou 4 casos de
dengue grave poderiam ser prevenidos a cada 1000 vacinados com infecção prévia por dengue
durante 5 anos de acompanhamento desde a primeira injeção.
Dados pediátricos em indivíduos abaixo de 9 anos de idade, ou seja, fora da idade de
indicação.
Em indivíduos dos 2 aos 8 anos de idade, ou seja, fora da idade de indicação, dados de
acompanhamento de segurança em longo prazo mostraram um risco de aumento de dengue
requerendo hospitalização, incluindo dengue clinicamente grave, em vacinados sem infecção
prévia por dengue.
-Dados de experiência pós-comercialização
Com base em relatos espontâneos, os seguintes eventos adversos adicionais foram relatados
após o uso comercial. Estes eventos foram muito raramente relatados, contudo as taxas exatas
de incidência não podem ser calculadas com precisão.
Distúrbios do sistema imunológico: alergia incluindo reações anafiláticas.
Se você apresentar qualquer efeito adverso, incluindo possíveis efeitos adversos não listados na
bula, fale com seu médico ou farmacêutico.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado
eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem
ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
Por favor, também informe à empresa entrando em contato com o Serviço de Informação sobre
Vacinação (SIV) para acompanhamento adequado.
- O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A
INDICADA DESTE MEDICAMENTO?
Nenhum caso de superdose foi relatado. Entretanto, em caso de superdose, é recomendado
entrar em contato com o Serviço de Informação sobre Vacinação (SIV) para acompanhamento
adequado.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente Socorro
médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722
6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS 1.1300.1159
Farmacêutica Responsável: Silvia Regina Brollo
CRF-SP nº 9.815
Fabricado por:
Sanofi Pasteur
Val de Reuil, França
Importado por:
Sanofi-Aventis Farmacêutica Ltda.
Rua Conde Domingos Papaiz, 413
Suzano – SP
CEP 08613-010
CNPJ 02.685.377/0008-23
Serviço de Informação sobre Vacinação: 0800 14 84 80
® Marca Registrada
IB171117



